
2024年6月19日,日本厚生劳动省药事审议会再生医学制品及生物技术小组委员会宣布,附加条件和期限批准SanBio株式会社生产销售首款治疗慢性创伤性脑损伤的再生医疗药物——脑内注射药物SB623(Vandefitemcel)。迄今为止,治疗脑损伤导致的运动性麻痹的唯一疗法是康复治疗,这是世界上首次批准使用干细胞的药物治疗该疾病。
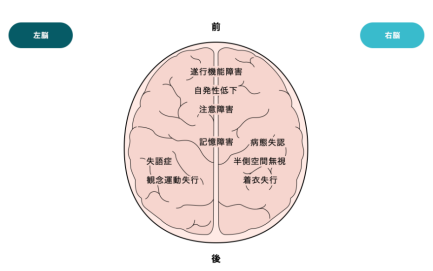


创伤性脑损伤是因头部受到强烈外力(例如交通事故或跌倒)而导致脑组织受损时发生的疾病。头部受伤的原因是多样化的,通常会导致终身残疾,例如半身瘫痪、感觉障碍和记忆障碍等。
创伤性脑损伤是全世界死亡和残疾的主要原因之一。 2016年全球约有2700万例急性创伤性脑损伤新病例和5550万例继发于创伤性脑损伤的慢性疾病新病例。创伤性脑损伤以及创伤性脑损伤继发的长期运动障碍严重影响患者的独立生活、就业和生活质量,成为全世界各国医疗系统的巨大负担。在美国,外伤性脑损伤存活下来的患者中,约有43%经历过长期运动障碍,约有317万人长期存在外伤性脑损伤继发的运动障碍。日本患病率约为每10万人中有474人。

属于多能干细胞的间充质干细胞(Mesenchymal Stem/Stroma Cells,MSCs)是干细胞家族的重要成员,目前已成为干细胞研究的热点。
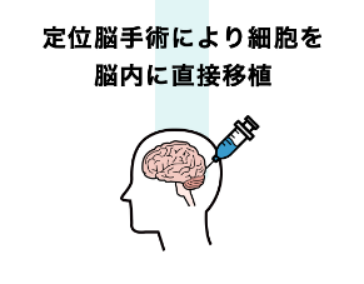
SB623是Sanbio株式会社研发的再生医疗药物,该药物将健康成人骨髓的间充质基质细胞加工培养为人骨髓加工间充质干细胞。通过脑立体定向手术将SB623注射到脑内受损的神经组织中,可以修复受损的神经细胞原有的再生能力,从而达到恢复已丧失功能的效果。
在日本和美国进行了针对创伤性脑损伤导致慢性运动功能障碍患者的2期双盲临床试验,在测定24周运动功能障碍变化的Fugl-Meyer功能改善评定中,SB623治疗组为8.3分,对照组为2.3分。没有发现新的安全问题,最常见的不良事件是头痛。追加提交“等效性/同质性数据”后,该跨时代的药物正式上市指日可待。

〒169-0072東京都新宿区大久保2-3-9ヴァリエ戸山203
北京市朝阳区光华路丙12号数码01大厦1502B
上海市杨浦区国宾路18号万达广场A座8楼B018室
03-6233-7171(东京)
010-64617880;18810230989(手机同微信)(北京)
021-6385-6282(上海)